Aminosäuren kommen in jedem Lebewesen dieser Welt vor und sind unverzichtbar für die Funktion einer Zelle. Diese sind fern der Erde vorhanden und kommen sogar in Kometen und eventuell auch in Gaswolken im Weltall vor. Sie bilden zusammen mit der DNS die Grundlage für komplexe sich selbst replizierende Systeme. Diese wunderbaren Moleküle werden entweder im Organismus selbst hergestellt oder müssen über die Nahrung aufgenommen werden (essentielle Aminosäuren).
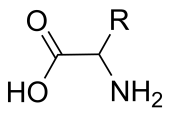
Als Polymer (über Peptidbindung miteinander verknüpft) spricht man bei α-Aminosäuren von Peptiden (bei kurzen Ketten) und ab einer gewissen Größe bei langkettigen Verbindungen von Proteinen. Sie können komplexe Strukturen bilden die Reaktionen katalysieren, Signale übertragen und Signale abschalten.
Lebensmittel Aminosäure
Da Aminosäuren eine solche Wichtigkeit für uns haben, ist der Bedarf nach Lebensmitteln die diese enthalten enorm groß. Daher ist es kein Wunder das uns Aminosäuren besonders gut schmecken können. Als unverknüpfte Aminosäuren können sie unseren Geschmack wesentlich beeinflussen. So kann die „Würzigkeit“ intensiviert werden (Glutaminsäure) oder der Zunge vorgespielt werden, dass Essen sei süß (Beispiele Glycin oder das Dipeptid Aspartam). Unser Geflügel, welches im Übrigen eine Aminosäure-Quelle für uns darstellt, benötigt gar weniger Futtermittel wenn die essentielle Aminosäure Methionin dem Futtermittel zugesetzt wird. Diese ist zumeist in Futtermittel wie Soja/Weizen nur in geringen Konzentrationen erhalten. Synthetisches Methionin ist zwar Erdöl basiert, jedoch kann man ihm zugute halten das 1 kg Methionin ca. 50 kg Fischmehl (34 kg Sojamehl) als Futterzusatz ersetzen kann. Dem Klima kommt dagegen zugute das die benötigte Fläche von Ackerland und damit eingesparter Dünger und weniger Waldrodung für die Geflügelzucht bedeutet. Als Folge sinkt damit der Bedarf an importiertem Soja, was weniger Transporte über die Weltmeere bedeutet und in der Summe die CO2 Bilanz verbessert.
Ein anderes Beispiel für die Rolle von Aminosäuren in unseren Lebensmitteln ist der Süßstoff Aspartam. Dieser besteht aus den beiden Aminosäuren Phenylalanin (verestert) sowie Asparaginsäure die über eine Peptidbindung (C-N) verknüpft sind. Prinzipiell eine gute Sache, weniger Zucker in unseren Lieblingsgetränken und Speisen, dafür aber trotzdem süßer Geschmack. Jedoch gibt es auch bedenken über den in der EU zugelassenen Süßstoff. Dieser steht in der Diskussion da einige Studien besagen er sei unbedenklich andere dagegen zu dem Schluss kommen er sei Gesundheitsschädlich und das obwohl dieser Süßstoff aus nur zwei Aminosäuren besteht die in jedem Körper vorkommen. Statt unserer Gesundheit zu schaden können Aminosäuren und Peptide als Bestandteil von Medikamenten im Gegenzug unsere Gesundheit auch erhalten. Wiederum werden einige Aminosäuren damit beworben, dass sie besonders wichtig für den Aufbau der Muskulatur sind (beim Training) oder besonders hilfreich beim Abnehmen, Stoffwechselerkrankungen oder im Fall von Diabetis wirken können. Der Effekt und die Wirkung bleiben auch hierbei teilweise umstritten und sind Gegenstand der Forschung. Alles in allem spielen die Aminosäuren in unserem Leben eine große, wenn auch oft unbewusste, Rolle.
Vielfalt Aminosäure
Die Natur beschränkt sich darauf weitestgehend 20 verschiedene α-Aminosäuren zu verwenden, die alle bereits im letzten Jahrtausend vor dem zweiten Weltkrieg entdeckt wurden. Die neuere Forschung konnte sogar zeigen das es 23 proteinogene, also proteinbildende, Aminosäuren gibt. Diese Aminosäuren unterscheiden sich vor allem durch ihre Ladung (Sauer/Basisch), als auch durch ihre Hydrophobizität oder Hydrophilizität. Außerdem ermöglichen manche unter Ihnen die Bildung von kovalenten Bindungen über ihre Seitenkette, so z.B. Cystein, und sorgen so für die Quervernetzung innerhalb oder zwischen Aminosäureketten. Die Aminosäure und ihre Polymere bilden mehr oder weniger stabile Proteinstrukturen die wichtige Funktionen auf molekularer Ebene erfüllen. Stellte man sich die Zelle als Rechner vor, so wäre die DNS unser Speicher, auf dem die Anleitung für den Bau und die Funktionsweise des Rechners gespeichert sind und die Proteine wären fast die vollständige Hardware zur Ausführung von Rechenoperationen, Eingabe von Daten (Rezeptoren) unter gleichzeitiger Wartung und Reperatur des Systems. Als katalytisch wirkende Proteine, auch Enzyme genannt, versorgen sie die Zelle mit Energie (z.B. über den Abbau von Zucker oder Fett). Die Einheit Zelle ist somit weitestgehend autark und muss nur mit Nährstoffen versorgt werden.
Neue Aminosäuren
Möchte man nun neue Funktionen erhalten, die so die Natur noch nicht vorgesehen hat, kommt man mit 20 oder 23 natürlichen proteinogenen Aminosäuren nicht viel weiter. Daher hat die organische Chemie ein großes Repertoire an vielen verschiedenen Derivaten entwickelt. Einziger haken, es fehlt teilweise der passende Katalysator um enantioselektiv Aminosäuren zu synthetisieren. Neben den Standard α-Aminosäuren (α bezeichnet die Stellung der Aminogruppe zur Säuregruppe im Molekül) gibt es viele verschiedene β und Aminosäuren die andere Konfigurationen aufweisen. Die Natur bildet nur in wenigen Fällen andere als α-Aminosäuren und bis dato gibt es in der Regel keine natürlichen Proteine mit β-Aminosäuren. Aber dieser Sachverhalt könnte gerade für die Entwicklung von therapeutischen Peptiden und Proteinen von Bedeutung sein. Baut man diese besonderen Aminosäuren in Peptide und Proteine ein, können diese nicht mehr effizient von Proteasen ( Enzyme die Proteine spalten) abgebaut werden. Außerdem ermöglichen sie Strukturmuster in Proteinen zu bilden die so mit keiner α-Aminosäure möglich wären.
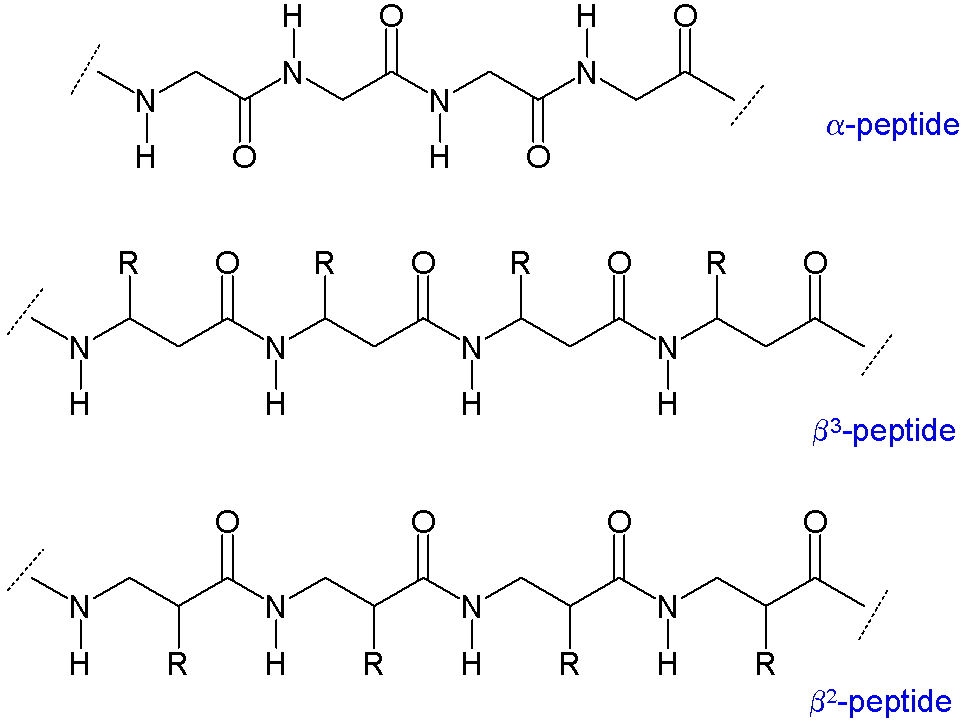
Das liegt daran, dass zwischen den Peptidbindungen jeweils ein weiteres Kohlenstoffatom liegt, dadurch erhält jede Aminosäure neue Möglichkeiten wie diese gedreht werden kann, bzw. welche Interaktionen innerhalb einer Kette zwischen den Aminosäuren statt finden können. Bei α Aminosäuren die aneinander geknüpft sind gibt es bestimmte Strukturen die in jedem Protein in einer ähnlichen Art und Weise vorkommen. Diese Strukturelemente werden als Sekundärstruktur bezeichnet. Hierbei gibt es Strukturen die als Faltblätter, Helices oder als Zufallsknäuel bezeichnet werden. Diese wiederum sind die Grundlage für noch komplexere Tertiärstrukturen. Beispielsweise ergeben 5 Faltblätter ein Faß.
Aus möglichst „einfachen“ Strukturen entstehen somit strukturell vielfältige Proteine. Prof. Seebach (ETH Zürich) , ehemaliger Student der Universität Karlsruhe, zeigte das eben für diese α-Aminosäuren bzw. α-Peptiden, analoge neue Strukturen auf der Basis von β-Aminosäuren/Peptiden gebildet werden konnten.Darüber hinaus sind diese β-Peptide gegen den Abbau durch Enzyme, genauer gesagt durch Proteasen, stabil. Die zunahme der strukturellen Vielfalt verspricht zu dem neue stabilere Strukturmuster.
In weiteren Arbeiten wurde untersucht wie Peptide wie z.B. das Interleukin 8, welches als Botenstoff bei der Neubildung von Gefäßen ein wichtige Rolle erfüllt, aus einem synthetischen Peptid bestehend aus α und β-Aminosäuren die gleichen Funktionen erfüllen kann wie sein natürlicher α-Peptid Zwilling. Wenn solche Peptide in Zukunft als Chemotherapeutika eine Rolle spielen, wären diese stabiler gegen den Abbau durch Proteasen. Eventuell wären diese auch kostengünstiger, da kein unmittelbarer Abbau im Organismus erfolgen würde. Die Vielzahl an neuen Strukturelementen die möglich sind, könnten viele stabilere Proteine und Peptide mit neuen Funktionen erzeugen. Insulin, welches in allen Menschen und Tieren die Aufnahme von Zucker aus dem Blut in die Zellen veranlasst, könnte durch β-Aminosäuren stabiler gestaltet werden. Was für die Lagerung oder für das Abbauverhalten im Blutkreislauf von Bedeutung sein könnte. Vielleicht werden auf diese Weise eines Tages Enzyme hergestellt die auch noch bei 150°C stabil sind?
β-Aminosäuren können auch heute schon in Wirkstoffen vorkommen. Ein bekanntes Beispiel ist hier für der Wirkstoff Paclitaxel, dieser stammt aus der Rinde der pazifischen Eibe und wird in der Behandlung von Krebs eingesetzt. Seine chemische Synthese ist besonders aufwendig und daher wird dieser Wirkstoff bis Heute entweder aus Eibenzellkulturen oder aus Nadeln der europäischen Eibe isoliert und derivatisiert. Ein Bestandteil von Paclitaxel ist unter anderem auch eine β-Aminosäure. Diese kann zwar rein chemische synthetisiert werden, aber zu meist wird nur ein Racemat hierbei erhalten. Ein Racemat ist eine 50:50 Mischung von einem Molekül welches zwar „Baugleich“ ist, aber z.B. einen Arm (also einen Rest) besitzt der räumlich in eine andere Richtung zeigt als sein Partner. Es ist so als hätte man einen Handschuh für die linke und die rechte Hand. Betrachtet man sich diesen Handschuh so sind Fingeranzahl und Fingerform zwar gleich (siehe auch Isomerie), aber so richtig passt der linke Handschuh dann doch nicht auf die rechte Hand. Ein Racemat erfüllt hierbei im Organismus andere Funktionen als nur ein Enantiomer. Ein Beispiel für die unterschiedliche Wirkung von Enantionmeren zeigte der Contergan-Skandal (Thalidomid). Diese Medikament wurde als Racemat verkauft nicht wissend, dass verschiedene Enantiomere verschiedene Auswirkungen haben können. Es zeigte sich jedoch, dass das (S)-Enantionmer eine schädigende Wirkung verursachte (erst viele Jahre später). Dies zeigt wie groß die Bedeutung der enantioselektiven Synthese von Wirkstoff ist.
Enzyme zur Synthese von β-Aminosäuren
Neben der Möglichkeit einzelne β-Aminosäuren bei Naturstoffsynthese, niedermolekularen Wirkstoffen, in Peptiden oder einzelnen in Proteinen einsetzen zu können, gibt es auch Ansätze β-Aminosäuren als biologisch-abbaubare Polyester-Verbindung , ähnlich einem Kunststoff, z.B. als Füllmaterial für Tabletten einzusetzen. Wie können jedoch diese β-Aminosäuren enantioselektiv hergestellt werden? Was auf dem rein chemischen Weg schwer erscheint ist mit Enzymen zur Synthese dieser wertvollen Moleküle durchaus möglich. Außerdem können organische Lösungsmittelabfälle reduziert werden und teils auch Energiekosten eingespart werden. Enzyme tragen eine wichtige Rolle die Chemie „grüner“ zu machen. In der Technischen Biologie am KIT beschäftigt man sich hierbei beispielsweise mit Transaminasen. Die Klasse dieser Enzyme ermöglicht die Umlagerung von Aminen auf auf ein Amino-Akzeptor-Molekül und dies bei Raumtemperatur in einem wässrigen System. Teilweise können so Reaktionen die auf klassischem chemischen Wege nur bei extremen Bedingungen ablaufen mit Enzymen unter Standardbedingungen ermöglicht werden.
Neben der genannten Klasse der Transaminasen, gibt es noch eine Vielzahl anderer Enzyme (z.B. Aminomutasen), die sich zur Darstellung von β-Aminosäuren eignen könnten. Entscheidend für den den Einsatz dieser Enzyme ist, ob sich diese einfach Herstellen lassen und unter Prozess-Bedingungen stabil und wiederverwertbar sind. Durch gelenkte Evolution und gezieltes Enzym-Design durch physikalische Simulationen können Enzyme dahingehend optimiert werden im Prozess adäquate Leistungen zu erzielen, hierbei ist nur die Frage wie viel Geld und Zeit zur Erforschung zur Verfügung stehen (Bsp. eine modifizierte Aminotransferase von Codexis und Merck). Die Firma Codexis und Merck zeigten wie ein Enzym prozesstauglich gemacht werden kann und erhielten den US Amerikanischen Award der Umweltbehörde EPA „EPA Presidential Green Chemistry Challenge Award-2010“ sowie den Edison-Patent-Award 2014 für ihre Arbeit im Bereich der Transaminase-Katalyse (Video). Hierbei konnten vor allem komplexe Verfahrenstechnik vermieden und die Menge an giftigen Abfällen reduziert werden.
In der Entwicklung von enzymatischen Synthesen sind teilweise aber nicht die Enzyme das grundlegende Problem, sondern instabile Substrate für β-Aminosäuren Synthese. Diese sind teilweise sind nicht geeignet um durch existierende und beschriebene Enzyme umgesetzt zu werden. Eine alternative zum Design eines Enzyms kann es auch sein, dass Synthese-Problem in einzelne Schritte zu unterteilen. Diese enzymatische Aufgabenteilung, kann es erlauben durch bekannte und beschrieben Enzyme eine Synthesestrategie zu entwerfen.
Enzym Kaskade
Eine Enzyme-Kaskade, also eine Aneinanderreihung von mehreren enzymatischen Reaktionsschritten, ist im Prinzip ein sehr kleiner künstlicher isoliert betrachteter Stoffwechselweg. Diese Enzym-Kaskaden lassen sich auf sehr viele Anwendungsbeispiele übertragen, vor allem im Bereich der Biosensorik sind diese bekannt. So können enzymatischen Reaktionen beispielsweise helfen, Giftstoffe in unserer Umwelt zu detektieren. Auch sind sogenannte Logikgatter mit Enzymen möglich, die man ansonsten eher aus der Elektronik kennt. Beispiel hierfür ist eine enzymatische „Schaltung“ zur Detektion von TNT und anderen Gefahrstoffen. Dieser Sensor stellt hierbei ein NOR (nicht-oder) Gatter da, sprich, wenn kein Gefahrstoff vorhanden ist von einer Reihe an vielen Gefahrstoffen, dann wird ein Signal ausgegeben „alles in Ordnung“, ist einer der Gefahrstoffe vorhanden gibt der Sensor ein Warnsignal aus.
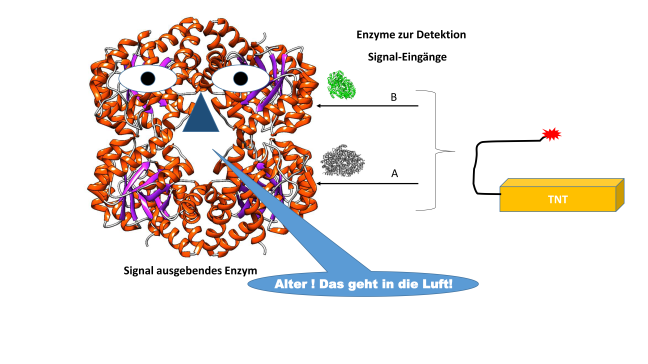
Der Komplexität solcher Gatter dürften keine Grenzen gesetzt sein.(sofern es aktive Enzyme gibt um einen Signalstoff umzusetzen ). Etwas komplizierter sind hierbei künstliche Stoffwechselwege. Möchte man nicht nur einen Sensor bauen, so sind zwei Reaktionsschritte oft nicht ausreichend um aus einem gegebenen Substrat das Zielmolekül zu erzeugen. Auch müssen teure Kofaktoren recycelt werden, die im Verlauf von enzymatischen Reaktionen verbraucht werden. Eine künstliche enzymatische Kaskade aus einfacher Glucose (Zucker)zur Synthese von Molekülen wie Aminosäuren ohne Mikroorganismen könnte so möglich werden. Dies hätte den Vorteil das Nebenreaktionen, die beim Einsatz von ganzen Zellen (wie z.B. Hefe), mittels artifizieller in-situ Stoffwechselwege vermieden werden könnten.Außerdem können die Reaktionsbedingungen in einem größeren Umfang variiert werden und eine Produktion von Biomasse vermieden werden.
In der Summe bleibt somit zu sagen, Aminosäuren gehören zu den wichtigsten Moleküle auf der Erde. Sie herzustellen kann sowohl für die Pharmazie als auch für die Lebensmittel-Industrie von großer Bedeutung sein. Die β-Aminosäure könnte dabei ein Grundstein für Proteine und Wirkstoffe mit verbesserten Eigenschaften darstellen.
